
发布时间:2020-09-27
有机污染场地/土壤修复技术主要包括物理、化学、生物等修复技术,其中,以土壤淋洗为代表的化学修复技术在工程实践中有了较快的发展。土壤异位淋洗是指对土壤进行挖掘和运输,然后添加相适应的淋洗剂,通过分离、洗脱,将污染土壤组分转移至淋洗液中,再单独处理淋洗液的方法。该技术可有效减少土壤的处理量,实现污染土壤减量化 [1]。在有机污染场地/土壤修复实践中,以有机氯农药(OCPs)为代表的疏水性有机污染物是土壤异位淋洗修复中的重难点,常常需要使用有机溶剂、表面活性剂等增效试剂,提高污染物在淋洗液中的溶解度,使OCPs从土壤中脱附出来再转移至淋洗剂里,再分离土壤与淋洗剂,使土壤中OCPs含量大量去除[2-4]。但经过淋洗以后的土壤结构会发生十分显著地改变,土壤营养成分下降,土壤动植物生存环境受到极大的影响;这一过程常常伴随微生物生存环境的变化,微生物是土壤库里最丰富的自然资源,如若微生物生境遭到破坏,会影响修复后的土壤再次使用。表面活性剂影响微生物降解有机污染物的作用机制已获得大量研究成果[5],但其在实际场地修复的应用中对土壤生境、尤其是微生物群落结构的影响研究较少,虽有研究在原位场地修复中发现多环芳烃污染(PAHs)场地/土壤中添加鼠李糖脂有利于提高土壤中PAHs优势降解菌丰度和功能[6]。然而异位修复,特别是场地/土壤淋洗过程中微生物生境的影响研究鲜有报道。为了探明土壤异位淋洗对农药污染土壤微生物群落结构影响,本文利用16S-rRNA高通量测序手段,重点研究经过异位淋洗以后的OCPs土壤中土著微生物群落结构与功能的变化,以期指导土壤淋洗工程实践土壤生态的影响及后续利用。
1实验部分
1.1材料和试剂
曲拉通100、皂角苷、鼠李糖脂:纯度大于70%,国药公司;强力土壤DNA提取试剂盒(PowerSoil®DNAIsolationKit):美国MoBio公司。OCPs混合标准药品购于Supelco (Bellefonte, PA, USA)公司。实验中待处理的土壤样品采集至浙江某历史农药厂周边土块。采用了网格布点法将厂区土壤样品混合并带回实验室检测其理化性质、土壤有机碳、土壤总碳、总氮和OCPs含量。土壤检测结果显示,该厂区内含有机碳含量0.41%,含砂砾6.2%,含粉粒40.2%,含粘粒55.2%,土壤类型为黏土;土壤原始pH为8.65;土壤污染物的原始含量如下:土壤性质共检测到目标OCPs超标物七种,包括滴滴涕、滴滴易、滴滴滴、α-六六六、β-六六六、γ-六六六及δ-六六六,土壤总OCP含量为385 ± 12 mg/kg。
1.2 OCPs土壤洗脱与堆放
向淋洗池中按土水比1:5(kg/L)加入浓度为0.4g/L的曲拉通100(Tx-100)、皂角苷、鼠李糖脂,另外投加相同浓度(0.4g/L)的皂角苷和皂角苷和Tx-100以质量比1:2组成的混合表面活性剂溶液。置于强力搅拌器下以200 r/min搅拌30分钟。然后以2000r/min的搅拌速率搅拌15分钟静置。设立四组洗脱土壤样品,外加原土样对比。组别分别命名为原土、Tx-100、皂角苷、鼠李糖脂以及S-T(皂角苷和Tx-100以质量比1:2组成的混合表面活性剂)。
1.3样品扩增及测序
采用SDS超声裂解法进行DNA提取,PCR所用的引物已经融合了Illumina测序平台的V4通用引物:
F: Illumina_uni_sequence-Read1_sequnce_GTGCCAGCMGCCGCGGTAA
R: Illumina_uni_sequence_(barcode)_read2_sequence_GGACTACHVGGGTWTCTAAT
这样避免了后续的建库流程。用1%琼脂糖凝胶电泳进行检测PCR产物,上样量为2ul。将经过磁珠纯化过后的产物进行Nanodrop检测,按照所到的值进行等量混合,2%琼脂糖凝胶电泳对混样进行电泳,采用AXYGEN的胶回收试剂盒回收;用Qubit对回收的文库进行定量,用qPCR进行接头效率检测,最后用Novaseq测序。
1.4测序数据分析
原始图像数据经base calling转化为序列数据,获得raw data或raw reads[5]。得到前期处理完的有效数据后,与NCBI(ftp://ftp.ncbi.nlm.nih.gov/blast/db/16SMicrobial.tar.gz)的微生物16S 数据库进行BLAST比对[7]。比对后的数据会进入样板库序列分类,对每个样板库的序列进行OTU注释,QIIME(version 1.8.0)工具包进行注释,相似度高(相似度 ≥ 97 %)的归为一类,注释后的数据进入GreenGene(version gg_13_8)数据库。OTU注释的数据经过QIIME(version 1.8.0)工具进行物种分类[8],将OTU序列准确的归类到界、门、纲、目、科和属等各级别,分类好的物种可进行微生物群落物种丰度、多样性指数以及系统进化分析。
2 结果与讨论
2.1 异位淋洗后土壤中微生物相对丰度的变化
图1为使用QIIME 软件计算得到的样本间总OTU丰度,场地/土壤中通过表面活性剂淋洗,相较于实验原土,各对照组别微生物丰度降低。原土的微生物丰度为0.15,经过Tx-100、皂角苷、鼠李糖脂以及S-T等表面活性剂清洗以后丰度仅为原土的1/10~2/3,说明经过清洗的土壤微生物生境影响较大,而且与表面活性剂的种类有关:这四组淋洗对照土中,对土壤影响最大的实验组是曲拉通100淋洗实验组,相较于非离子型表面活性剂(曲拉通100),生物表面活性剂鼠李糖脂对土壤微生物的相对丰度的影响较小,土壤中微生物相对丰度是其他组别的两倍及以上;非离子表面活性剂与生物表面活性剂皂角苷组成的混合表面活性剂影响大于鼠李糖脂,但是小于单独使用皂角苷的组别。这四种表面活性剂对有机污染物的淋洗去除研究均有报道,但是对微生物相对丰度的影响报道较少,Wang et al. 针对另一类疏水性有机污染场地/土壤-多环芳烃污染(PAHs)场地/土壤中梳理糖脂对微生物群落结构的影响进行了分析,发现直接投加梳理糖脂有利于提高土壤中PAHs优势降解菌丰度和功能,浓度过高(大于该表面活性剂的临界胶束浓度)也会影响微生物群落结构的影响,与本研究的结果具有一致性[5]。
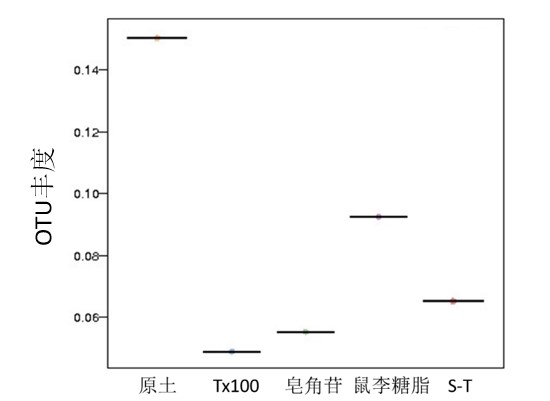
图1不同洗脱土壤微生物OTU丰度分布
Fig. 1 Distribution of microbial abundance (OUT) in different soil after elution
2.2 洗脱土壤中微生物属类的变化
表面活性剂作用下土壤细菌各个类别的数量发生了巨大的变化,经表面活性剂清洗的土壤较原土均呈现下降的趋势(图2)。比较这五类土壤的细菌属的信息(图3)可知,原始土壤中,(Bacteriodes)占主要成分(71%),为原始土壤中的主要成分;在这些表面活性剂作用的土壤中,拟杆菌属的成分大幅降低,曲拉通100作用土壤中为30%,皂角苷作用土壤中为20%,鼠李糖脂作用组为20%,非离子表面活性剂与生物表面活性剂皂角苷组成的混合表面活性剂作用土壤中为25%。表面活性剂淋洗以后,相应地,鞘脂单胞菌(Sphingomonas)降低了5~6个百分比,芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)各降低1.8~2.2和0.7~0.9个百分比。纤维菌属(Flavobacterium)和其他菌属的成分都有显著增加。表面活性剂作用下的土壤,鞘脂单胞菌、芽孢杆菌和假单胞菌的比例均明显减少,鞘脂单胞菌尤为突出,这三种表面活性剂呈现曲拉通100>皂角苷>鼠李糖脂的趋势。而上述降低的菌属,鞘脂单胞菌、芽孢杆菌和假单胞菌均为环状有机物降解菌[9-10]。说明用于淋洗的表面活性剂能降低土壤土著微生物菌群的降解能力。
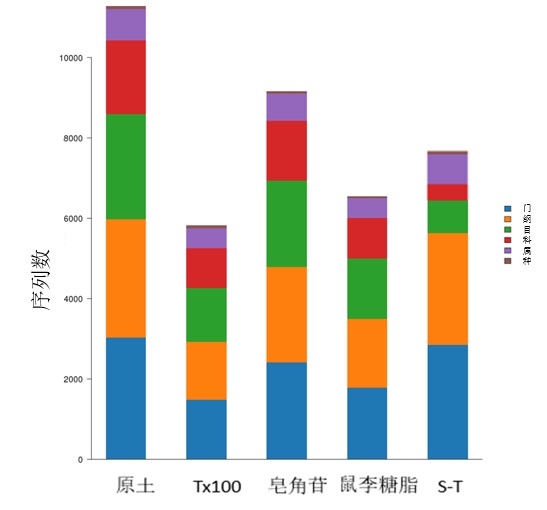
图2各土壤中类别分类
Fig. 2 Classification of microbial community in different soil
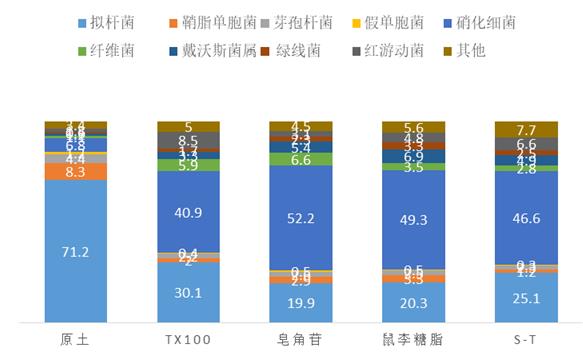
图3 各土壤中属的分布
Fig. 3 Distribution plot of genus in different soil
2.3 洗脱土壤中基因功聚类分析
通过聚类分析可以清晰地看到各类型土之间的差距,距离越大差距越大[11-12]。曲拉通100、皂角苷、鼠李糖脂以及混合表面活性剂与原土之间的微生物功能差距均很大(图4),根据计算结果,其显著性较大,p<0.05,据此说明了洗脱对土壤微生物功能的显著影响。聚类分析也可以直观地反映出不同表面活性剂对洗脱土壤基因功能的影响[13],相较于非离子表面活性剂曲拉通100,与洗脱土壤中微生物相对丰度的变化规律一致,生物表面活性剂皂角苷对土壤微生物生境的影响大于鼠李糖脂,混合表面活性剂次之,鼠李糖脂对土壤微生物基因功能的影响最小。由此也反映出生物表面活性剂相较于化学表面活性剂而言,对土壤微生物环境的生境影响较小,进而对微生物群落结构和功能的影响程度能够降至较低水平。由此可为土壤增溶洗脱过程中表面活性剂的选择提供依据。
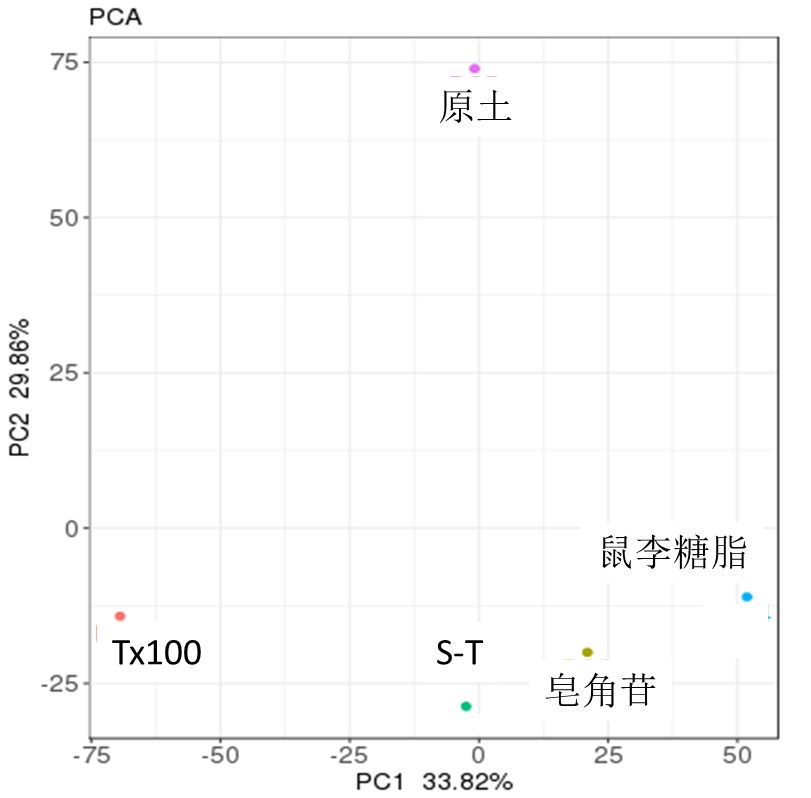
图4 各土壤微生物功能聚类分析
Fig. 4 Clustering analysis of microbial function in different soil
3 结论
通过比较不同表面活性剂,与原土之间的微生物相对丰度、界门纲目科属种间分布差异、属的差异以及基因功能聚类分析表明,洗脱对土壤微生物结构和功能带来了显著影响,土壤功能朝着下降的趋势发展,为此在土壤淋洗工程实践中,要充分考虑土壤生态的影响及后续利用。
(1)对土壤影响最大的实验组是曲拉通100淋洗实验组,相较于非离子型表面活性剂(曲拉通100),生物表面活性剂鼠李糖脂对土壤微生物的相对丰度的影响较小,土壤中微生物相对丰度是其他组别的两倍及以上;非离子表面活性剂与生物表面活性剂皂角苷组成的混合表面活性剂影响大于鼠李糖脂,但是小于单独使用皂角苷的组别。
(2)表面活性剂作用下的土壤,Sphingomonas、Bacillus和Pseudomonas的比例均明显减少,Sphingomonas尤为突出,这三种表面活性剂呈现曲拉通100>皂角苷>鼠李糖脂的趋势,用于淋洗的表面活性剂能降低土壤土著微生物菌群的降解能力。
(3)生物表面活性剂相较于化学表面活性剂而言,对土壤微生物环境的生境影响较小,进而对微生物群落结构和功能的影响程度能够降至较低水平。这些结果可为土壤异位淋洗过程中表面活性剂的选择提供依据。
[1] Romantschuk, M., Sarand, I., Petanen, T., et al. Means to improve the effect of in situ bioremediation of contaminated soil: an overview of novel approaches[J]. Environmental Pollution, 2000, 107: 179-185.
[2] Silva, L., Cachada, A., Freitas, A.C., et al. Assessment of fatty acid as a differentiator of usages of urban soils[J]. Chemosphere, 2010, 81:968-975.
[3] Simarro, R., González, N., Bautista, L.F., et al. Assessment of the efficiency of in situ bioremediation techniques in a creosote polluted soil: Change in bacterial community[J]. Journal of Hazardous Material, 2013, 262: 158-167.
[4] Slater, G.F., Cowie, B.R., Harper, N., et al. Variation in PAH inputs and microbial community in surface sediments of Hamilton Harbour: Implications to remediation and monitoring[J]. Environmental Pollution, 2008, 153:60-70.
[5] 张栋. 表面活性剂对PAHs微生物界面行为的影响及调控机制[M]. 博士学位论文,浙江大学,2013.
Zhang, D. Surfactant controlled bacterial interfacial behaviors of PAHs and its mechanisms[M]. Doctoral Dissertation, Zhejiang University, 2013.
[6] Wang L.W., Li F., et al. Shifts in microbial community structure during in situ surfactant enhanced bioremediation of polycyclic aromatic hydrocarbon-contaminated soil[J]. Environmental Science and Pollution Research,2016,23: 14451-14461.
[7] Törneman, N., Yang, X., Bååth, E., et al. Spatial covariation of microbial community composition and polycyclic aromatic hydrocarbon concentration in a creosote-polluted soil[J]. Chemosphere, 2008, 27: 1039-1046.
[8] Langille M.; Zaneveld J.; Caporaso J., et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J]. Nature Biotechnology, 2013, 31: 814-821.
[9] Wang, C.P., Li, J., Jiang, Y., Zhang, Z.Y., 2014. Enhanced bioremediation of field agricultural soils contaminated with PAHs and OCPs[J]. International Journal of Environmental Research, 2014, 8: 1271-1278.
[10] Zhang, D., Zhu, L. Effects of Tween 80 on the removal, sorption and biodegradation of pyrene by Klebsiella oxytoca PYR-1[J]. Environmental Pollution, 2012, 164:169-174.
[11] Zheng, G., Selvam, A., Wong, J.W. Enhanced solubilization and desorption of organochlorine pesticides (OCPs) from soil by oil-swollen micelles formed with a nonionic surfactant[J]. Environmental Science & Technology, 2012, 46:12062-12068.
[12] Lee S.; Kweon J.; Kim H. Selective biodegradation of sorbitan ethoxylated surfactants by soil microorganisms[J]. International Biodeterioration & Biodegradation, 2013, 85:652-660.
[13] Mulligan C. Environmental applications for biosurfactants[J]. Environmental Pollution, 2005, 133(2):183-198.